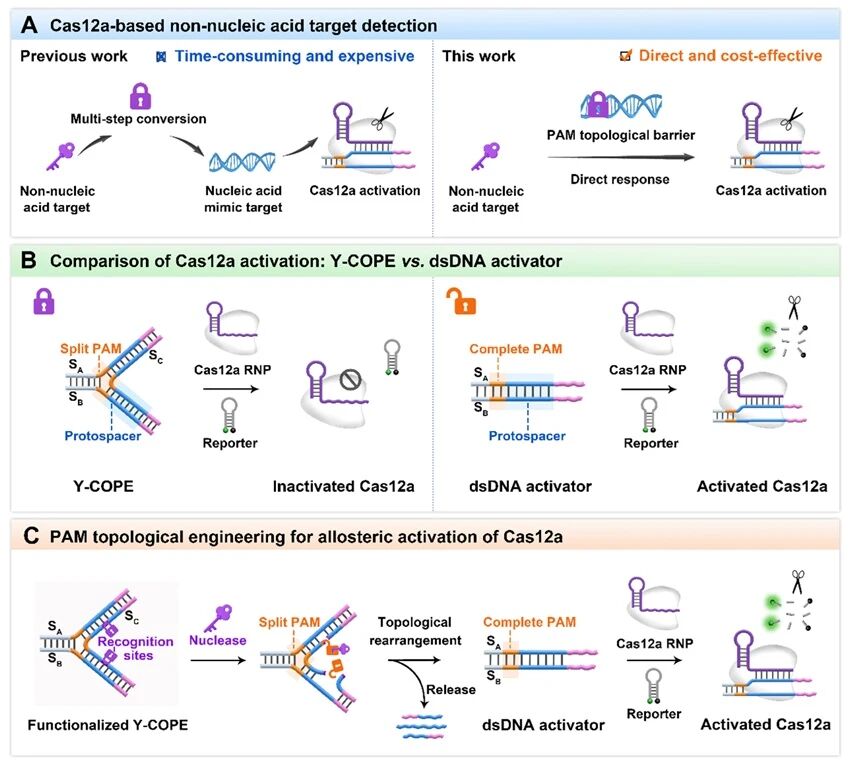
CRISPR-Cas12a系统因其高特异性和高效切割活性,已成为分子诊断领域的重要工具。然而,其在检测非核酸靶标(如酶、蛋白质等)时,通常需要多步识别和转化过程将靶标转化为核酸模拟靶标,过程复杂、成本高且耗时。近期,重点实验室卓颖教授团队在《Angewandte Chemie-International Edition》上在线发表了题为“Allosteric Activation of Cas12a via PAM Topological Engineering for Direct and Rapid Detection of Nucleases”的热点研究论文(Hot Paper)。提出了一种通过邻近间隔区基序(PAM)拓扑工程策略,实现了对Cas12a活性的精准调控,并成功用于多种核酸酶的直接、快速检测。
具体而言,该研究团队通过将PAM序列分裂并嵌入三叉连接中心,设计了一种含有Cas12a激活子序列的Y形DNA结构(Y-COPE)。这种精心设计的拓扑结构有效阻断Cas12a对PAM的识别,从而抑制其活性。当目标核酸酶识别切割特定位点后,释放DNA片段并动态修复PAM的双链结构,从而激活Cas12a并触发信号输出。
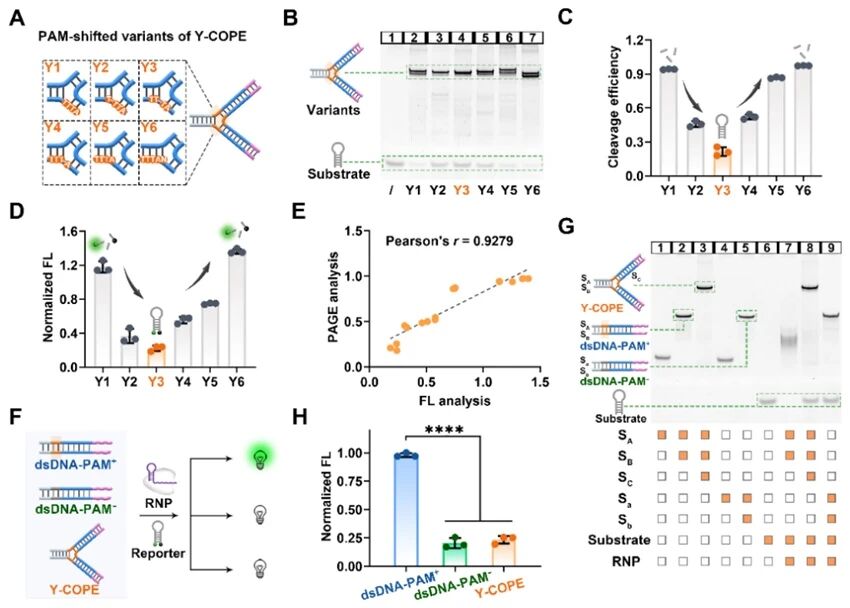
首先,通过合理设计一系列Y-COPE变体(Y1–Y6),逐步将PAM(5′-TTTA-3′)从分支远端移至茎部近端,研究发现Y3变体对Cas12a的抑制效果最强。凝胶电泳(PAGE)和荧光分析结果高度相关(Pearson’s r = 0.9279),证实PAM拓扑结构对Cas12a活性具有可靠有效的调控作用。
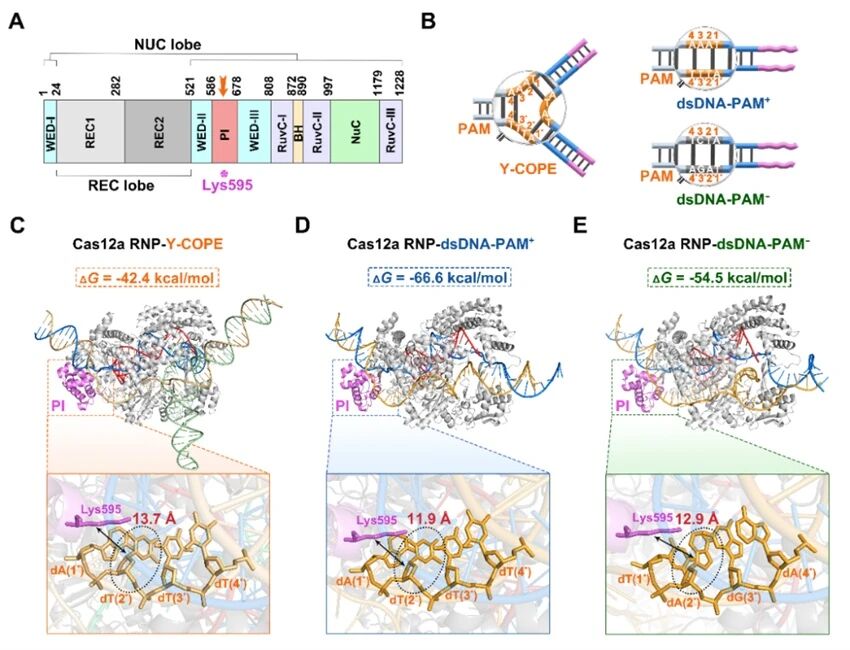
通过结构建模和理论结合能分析计算发现,Y-COPE与Cas12a RNP的结合自由能比经典dsDNA激活子高24.2 kcal/mol,且PAM与Cas12a蛋白PI结构域中关键残基Lys595之间的中心距离增加了1.8 Å,从机制上揭示了PAM拓扑结构抑制Cas12a活性的作用机制。
最后,作为概念验证,该团队成功构建了用于尿嘧啶DNA糖基化酶(UDG)和核糖核酸酶H(RNase H)检测的功能化Y-COPE变体。UDG检测限达2.69×10–5 U/μL,RNase H检测限低至2.55×10–7U/μL,且在复杂生物基质中检测性能优良,显示出高的特异性和抗干扰能力。